Como deve ser a avaliação da rotina de um paciente com dispositivo ? Por ora fora da realidade no Brasil e uma prática comum em países desenvolvidos, os ambulatórios de LVAD ( Left Ventricule Assist Device) tem crescido de maneira exponencial – com o aumento do número de implantes destes dispositivos pelo mundo. Levantaremos aqui os principais pontos necessários para o manejo cotidiano destes pacientes em nível ambulatorial:
1) Anamnese:
Uma história clínica objetiva deve contemplar pelo menos os seguintes pontos:
– Capacidade Funcional ( NYHA)
– Realização de atividade física: os pacientes devem ser encorajados a realizar atividade física ( sem contato, baixo impacto) para aumentar sua capacidade física, resistência e força muscular.
– Cuidados de rotina: troca diário de curativo no orifício de saída do cabo de energia, evitar exposição á agua dos componentes externos do dispositivo.
– Sangramentos: pergunta ativamente sobre sangramentos de TGI, melena, epistaxe
– Infecção: febre, saída de secreção pelo orifício do cabo de energia, calafrios, …
– Urina: questione sobre colúria ou urina ‘cor de coca-cola’. Se presente podem indicar hemólise pelo dispositivo.
2) Exame Físico:
Pacientes com LVAD podem ter fluxo não pulsátil de sangue pelo funcionamento contínuo do dispositivo durante sístole e diástole, por isso alguns pacientes, principalmente aqueles que não abrem a valva aórtica ( que depende da função nativa do VE). Por isso esses pacientes podem não ter pulso, nem central nem periférico. Desta maneira, a medida mais confiável de se obter pressão arterial é através da insuflação de manguito associada com um aparelho de doppler de fluxo na topografia da artéria braquial, quando começar a se ouvir sons pelo aparelho do doppler o valor da pressão representará uma Pressão entre a PAS e PAM. Deve-se ter como meta manter essa pressão entre 70-80 mmHg com uso de múltiplos anti-hipertensivos se necessário.
A Ausculta cardíaca deverá apresentar murmúrio característico do funcionamento do dispositivo ( murmúrio contínuo “hum”), também pode-se auscultar B2 ( que fornece informação sobre abertura da valva aórtica de maneira intermitente, em todo os ciclos ou sem abertura) e sopro de insuficiência mitral.
Examine o aspecto do orifício de saída do cabo de energia (“driveline”) para avaliar sinais de infecção.
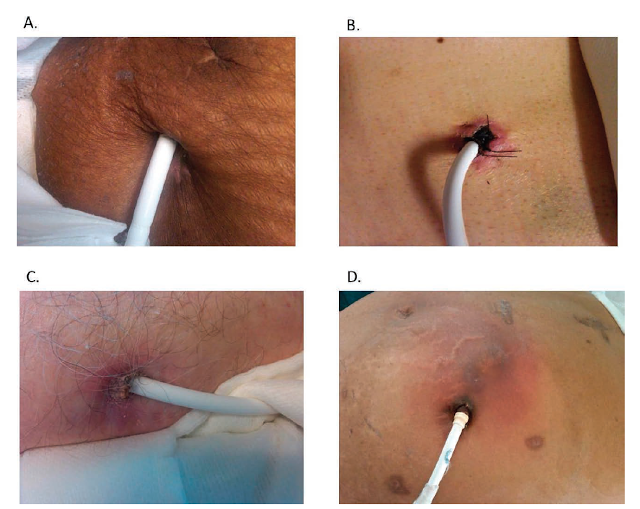 |
| Exemplos do orifício de saída do cabo de energia. A: normal. B: discreta eritema perioficial em paciente no período pós-operatório imediato, ainda com os fios de sutura na pele ( em geral deixa-se os fios por 3 meses). C: eritema e saída de secreção discreta pelo orifício. D: celulite com eritema franco, saída de secreção e em geral com palpação doloroso ao Exame Físico. Fonte: Estep et al. Continuous flow left ventricular assist devices: shared care goals of monitoring and treating patients. Methodist Debakey Cardiovasc Journal 2015 |
3) Avaliação do dispositivo:
– Revisão de Alarmes e parâmetros do dispositivo: Conectando-se o dispositivo ao console pode-se verificar as informações fornecidas pelo dispositivo: Força, Índice de Pulsatilidade, Estimativa do fluxo e revisar todos os alarmes do dispositivo. A Avaliação dos alarmes é fundamental para avaliar possíveis complicações relacionadas ao dispositivo, sempre tente correlacionar o tipo de alarme ( aumento de força, diminuição do índice de pulsatilidade, alarme de bateria) com sintomas ( pré-síncope, hipotensão, hipovolemia, sangramentos, dispnéia)
Ressalta-se aqui que o dispositivo não consegue medir objetivamente o fluxo, ele apenas estima o fluxo de acordo a força que ele está funcionando, por isso grandes alterações da viscosidade do sangue (aumento ou queda de hematócrito) podem fazer com que essa estimativa esteja errada ( com o sangue mais ‘denso’ o dispositivo tem que gastar muito mais força para manter o mesmo fluxo quando comparado com sangue menos ‘denso’).
O que é o índice de pulsatilidade ? A contração do VE do paciente gera uma variação de fluxo no dispositivo ( a contração do VE “ajuda” a ejeção pelo dispositivo por diminuir a diferença de pressão entre a via de entrada e saída do dispositivo – entre VE e Aorta), essa variação de fluxo é medida e a cada 15 segundos é dado uma valor da média da pulsatilidade – o índice de pulsatilidade. O índice de pulsatilidade se relaciona de maneira inversa com a dependência do paciente do dispositivo, quando maior o índice melhor será função do VE ( e um parâmetro que pode indicar recuperação de função ventricular). Alterações no índice de pulsatilidade podem indicar comprometimento abrupto da função ventricular esquerda do paciente como em situações como desidratação, hipovolemia por sangramento, tamponamento, falência ventricular direita.
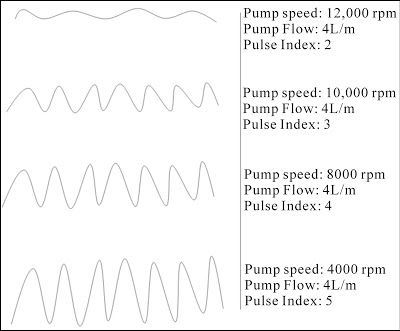 |
| Fluxo pelo dispositivo e Índice de Pulsatilidade. Quanto maior a variação do fluxo maior será o índice de pulsatilidade, usualmente indicando que o VE está sendo efetivo. Em todas os traçados o fluxo médio pelo dispositivo é o mesmo ( 4L/min) mas o índice de pulsatilidade varia de 2 a 5 com a diminuição da velocidade do dispositivo ( com a diminuição da velocidade em RPM do dispositivo o VE passa a ‘ajudar’ mais na ejeção do sangue). Fonte: Robert P. From. Stroke and Left Ventricular Assist Device (LVAD). Open Journal of Anesthesiology, 2013 |
– Ajuste de velocidade do dispositivo: com a ajuda do ecocardiograma transtorácico pode-se realizar um teste de rampa. Esse teste consiste em fazer uma avaliação dos diâmetros do VE, FEVE, abertura ou não da valva aórtica, presença e quantificação de insuficiência tricúspide de acordo com a velocidade do funcionamento do dispositivo. Repete-se o ECO para diferente níveis de velocidade ( RPM – rotações por minuto) do dispositivo. Desta maneira pode-se tentar deixar o dispositivo funcionando em uma velocidade “ideal”aonde: i) a valva aórtica abra de maneira intermitente ( estudos sugerem que isto possa diminuir as complicações vasculares do dispositivo e Insuficiência Aórtica a longa prazo); ii) a insuficiência mitral e tricúspide seja mínima; iii) mantenha-se uma PAM > 65; Diâmetro diastólico do VE < 60mm e sistólico < 50mm.
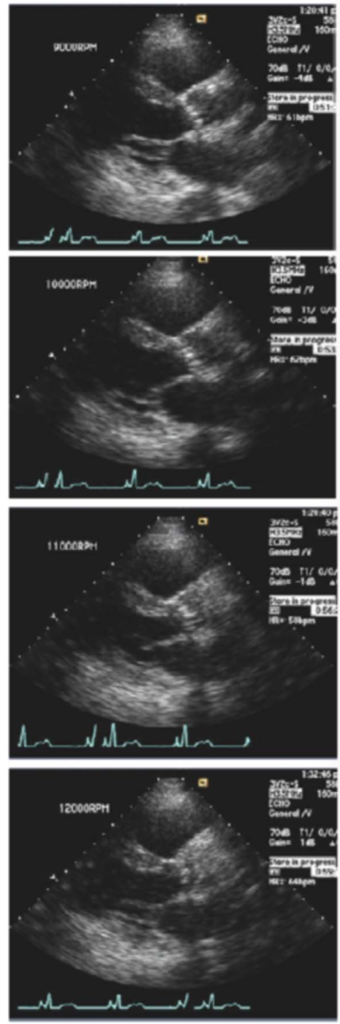 |
| Teste de Rampa em um paciente com LVAD. Aumento progressivo da velocidade do dispositivo de 9000 para 12000 rpm com VE em paraesternal eixo longo. O VE diminui progressivamente de diâmetro com o aumento da velocidade do dispositivo. Fonte: Clinical management of continuous-flow left ventricular assist devices in advanced heart failure. JHLT 2010 |
4) Exames laboratoriais:
A maioria dos centros realiza os seguintes exames de rotina:
– Uréia/Creatinina/Eletrólitos
– Hemograma Completo ou Hb/Ht: avaliação de possíveis sangramentos e hemólise
– DHL: avaliação de hemólise ( alguns centros avaliam o DHL da seguinte maneira: obtém um DHL “basal” antes da alta hospitalar e este serve como valor de comparação para os exames laboratoriais durante o seguimento ambulatorial – o DHL destes pacientes em geral sempre estará acima dos valores de referência)
– INR: ajuste da dose de warfarina
5) Medicações
– Anticoagulação/Antiagregação: pacientes com LVAD devem utilizar warfarina com meta de INR entre 2,0 e 2,5 e AAS na dose 81-325 mg
– Medicações para Insuficiência Cardíaca: principalmente para pacientes com potencial de recuperação da função ventricular deve-se manter os pacientes em classes de medicação com efeito comprovado: Beta-Bloqueadores, iECA e Aldosterona. Idealmente as medicações devem estar nas doses máximas toleradas e testadas nos estudos clínicos
Leitura Recomendada:
1) Wilson et al. Ventricular Assist Devices: Outpatient Management. JACC 2009
2) S.E.A. Felix et al. Continuous-flow left ventricular assist device support in patients with advanced heart failure. EJHF 2012
3) De Vore et al. Medical Management of Patients With Continuous-Flow Left Ventricular Assist Devices. Curr Treat Options Cardiovasc Med. 2014
4) Estep et al. Continuous flow left ventricular assist devices: shared care goals of monitoring and treating patients. Methodist Debakey Cardiovasc Journal 2015
5) Smith and Franzwa. Outpatient LVAD management. J Thorac Disease 2015
6) Slaughter et al. Clinical management of continuous-flow left ventricular assist devices in advanced heart failure. JHLT 2010