O implante de um dispositivo de assistência ventricular de longo prazo não é inócuo, o sistema cardiovascular passa a depender do meio externo para manter a perfusão sistêmica e este funcionamento é muito distinto da fisiologia normal. Apenas para exemplificar: i) existe um corpo estranho dentro do VE e da aorta – local que pode ser sítio de trombose e formação de coágulos; ii) a mudança do fluxo de sangue ( pulsátil para fluxo contínuo) também tem grande ônus, estudos indicam que este tipo de fluxo predispõe a má-formação arterio-venosa no trato gastrointestinal e iii) o fluxo do sangue pela bomba destrói os polímeros do fator de von Willbrand, podendo causar sangramentos mucosos. As complicações do implante do dispositivo são extremamente comuns, dados do registro INTERMACS estimam que aproximadamente 80% dos pacientes tiveram algum evento adverso importante nos primeiros 2 anos após o implante do dispositivo ( incluindo sangramento, infecção ou arritmias)
De maneira didática, iremos dividir as principais complicações:
1) Infecção
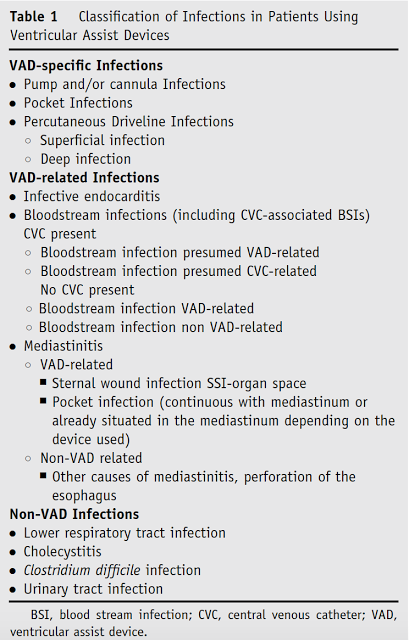
O fato de existir um pertuito comunicando o meio externo ao espaço pericárdico/endocárdico predispõe estes pacientes a desenvolverem algum tipo de infecção após o implante do dispositivo. Existe um grande espectro de gravidade que inclui: infecções cutâneas (óstio do cabo de energia, que podem ser subclassificadas em superficiais e profundas), infecção da loja do dispositivo (para dispositivos de implante peritoneal – HeartMate II), infecção do dispositivo em si ( cânulas ou motor) endocardite e sepse. Existem ainda as infecções associadas ao dispositivo como endocardite, corrente sanguínea e mediastinite, que dependendo do contexto podem estar relacionadas ao dispositivo ou não ( vide figura 1)
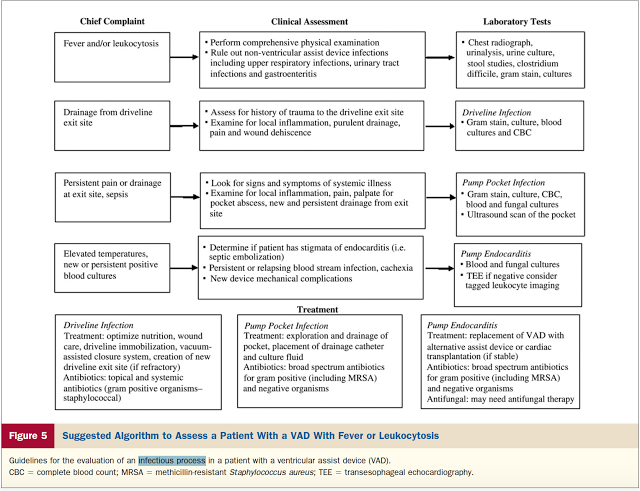
O limiar para suspeição de infecção deve ser muito baixo, pois muitas vezes os sintomas e sinais são inespecíficos e graduais. Recomenda-se realizar hemocultura se a história clínica configurar sinais de infecção sistêmica, exames laboratoriais, USG para avaliar a loja do implante. Em casos de infecções superficiais recomenda-se coleta de cultura da secreção oscila a fim de guiar a antibioticoterapia. O tratamento depende do tipo de infecção incluindo ATBterapia tópica para infecções cutâneas superficiais; ATBterapia sistêmica para infecções cutâneas profundas e infecção de loja, associada com drenagem cirúrgica ou não; ATBterapia endovenosa e remoção de dispositivo para infecções de bomba ou de endocardite relacionada a bomba.
|
Classificação das infecções de dispositivos. Divide-se em 3 subtipos: infecções específicas do dispositivo ( percutânea, loja e dispositivo em si), infecções relacionadas ao dispositivo ( endocardite, corrente sanguínea e mediastinite) e infecções SEM relação com o dispositivo. Fonte: Hannan MM, et al. Working formulation for the standardization of definitions of infections in patients using ventricular assist devices. J Heart Lung Transplant. 2011
|
2) Sangramentos
Pacientes com LVAD estão predispostos a ter sangramentos por diversos motivos: deficiência adquirida de fator de von Willebrand, anticoagulação sistêmica, inibição adquirida da agregação plaquetária e angiodisplasia ( relacionada a baixa pressão de perfusão e fluxo não pulsátil)
Os sítios mais comuns de sangramento são: TGI, torácicos ( em geral por babação nas conexões do dispositivo com Aorta e VE) e Sistema Nervoso Central. Os sangramentos para a cavidade torácica em geral ocorrem nos primeiros dias após o implante do dispositivo e se não forem auto-limitados necessitam de revisão cirúrgica. Os sangramentos de TGI e SNC em geral são mais tardios e mais frequentes.
O manejo de sangramentos depende da estabilidade hemodinâmica do paciente na apresentação, valor da hemoglobina e valor do INR no momento do sangramento. Em linhas gerais o tratamento deve:
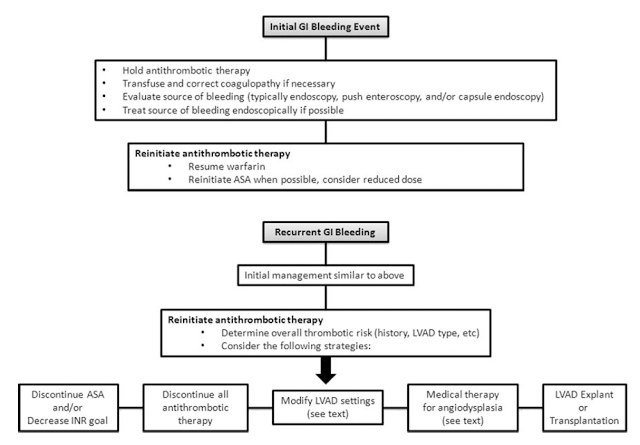
– Controle o local de sangramento: para sangramentos de TGI o tratamento endoscópico em geral é o ideal. Alguns casos no entanto apresentaram grande número de lesões e são recorrentes, para estes casos uma fármaco com grande potencial de diminuir o número de sangramentos é o octreodite ( vide figura 3)
– Suspensão da anticoagulação até resolver o sangramento: a anticoagulação pode ser suspensa de maneira segura de semanas até meses para o controle adequado do sangramento até estabilização do paciente
– Reversão da anticoagulação: em casos extremos com instabilidade hemodinâmica pode-se reverter a anticoagulação com Plasma Fresco Congelado, Complexo protrombínico e até transfundir plaquetas como tentativa de melhorar a função hemostática planetária
– Transfusão de Hemoconcentrado: não há recomendação absoluta de corte de hemoglobina para transfusão de hemácias, deve-se levar em conta a velocidade da queda, status hemodinâmico, valor do Hb basal e Hb após sangramento.
– Considere diminuir a dosagem de anticoagulação: após estabilização do paciente
– Para sangramentos do SNC: deve ser realizado acompanhamento conjunto com a equipe da neurologia com suspensão da anticoagulação/antiagregração no momento do diagnóstico. A reintrodução varia de acordo com a extensão do sangramento, o mecanismo do sangramento (embolização de coágulo do dispositivo, rotura de vasointracraniano, ..) e deve ser guiada pela interconsulta da neurologia. Ressalta-se que o controle ambulatorial da pressão arterial diminui o risco de sangramento para SNC
3) Hemólise
O fluxo do sangue pela bomba gera turbilhonamento do fluxo e consequente aumento da pressão de cissalhamento sobre as hemácias circulantes, causando hemólise. Para o diagnóstico de hemólise o DHL parece superior a haptoglobina e a bilirrubina indireta. O diagnóstico de hemólise é importante pois quando associada a alterações de parâmetros de funcionamento da bomba e/ou sinais de hipoperfusão pode ser indicativo de formação de trombos no sistema do dispositivo – que aumentam o risco de hemólise.
Na avaliação do paciente com hemólise também deve-se excluir acotovelamento das cânulas de entrada e saída ( em geral com TC de tórax com contraste)
4) Arritmias
As arritmias ventriculares não são infrequentes em pacientes com dispositivo de assistência circulatória, principalmente naqueles com cardiopatia por doença arterial coronariana (“cardiomiopatia isquêmica”. Ressalta-se que pacientes com TV ou até mesmo fibrilação ventricular podem estar andando, falando e praticando atividade física sem nenhum sintoma, pois o débito cardíaco é mantido pelo dispositivo, no entanto em alguns casos a arritmia ventricular pode levar a diminuição do fluxo pelo aparelho pela diminuição do pré-carga/influxo pelo dispositivo devido a insuficiência do ventrículo direito – usualmente os alarmes de baixo fluxo e queda da pulsatilidade serão disparados pelo dispositivo. Pode-se realizar cardioversão elétrica para pacientes com TV associada com baixo fluxo pelo dispositivo e/ou instabilidade hemodinâmica. Otimização da dose de beta-bloqueador e introdução de amiodarona costuma ser o manejo de pacientes com vários episódios de TV.
Uma causa comum de TV nestes pacientes são os eventos de sucção – quando a cânula de entrada do dispositivo que está no VE encosta no endocárdio e succiona uma porção do septo, essa irritação focal pode ser um gatilho para a arritmia. Nestes casos deve-se tratar a causa da sucção ( hipovolemia em geral ou velocidade do dispositivo extremamente alta). O diagnóstico desses eventos como
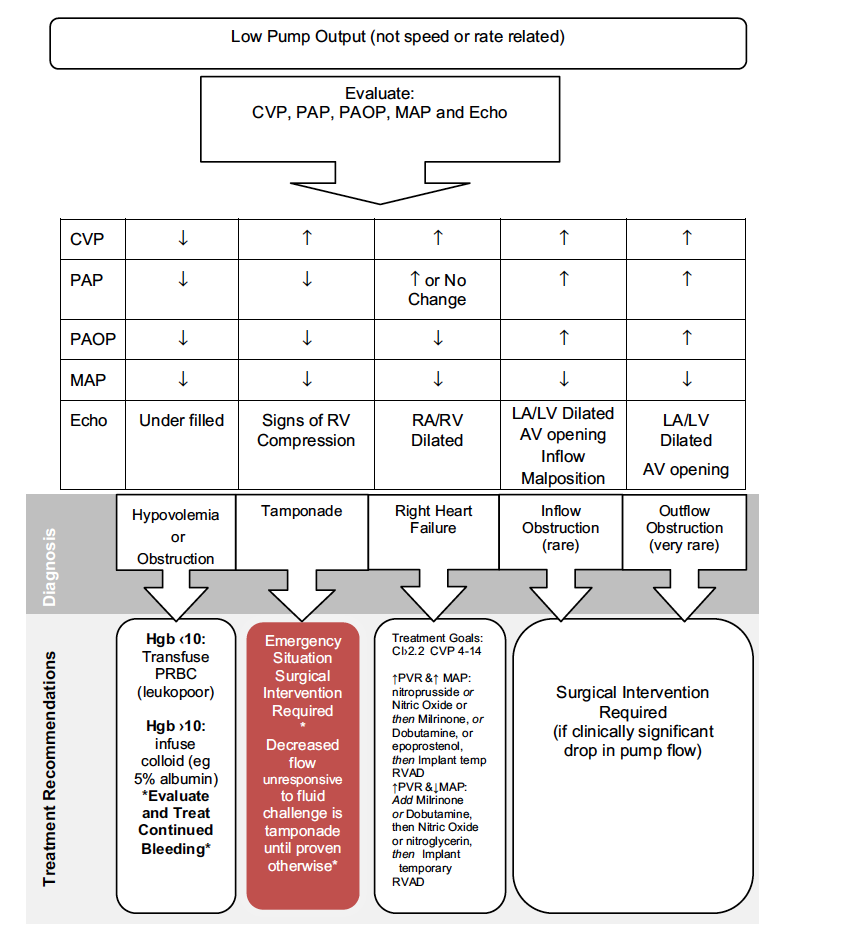
5) Disfunção de Bomba
Principal razão pelo quais os dispositivos de segunda e terceira geração superam os dispositivos da primeira geração é pela sua durabilidade e resistência. No entanto mesmo estes dispositivos mais modernos podem parar de funcionar, por diversas causas. Apontaremos aqui as principais causas de disfunção do dispositivo bem como um algoritmo diagnóstico e de manejo para pacientes que apresentam disfunção de bomba.
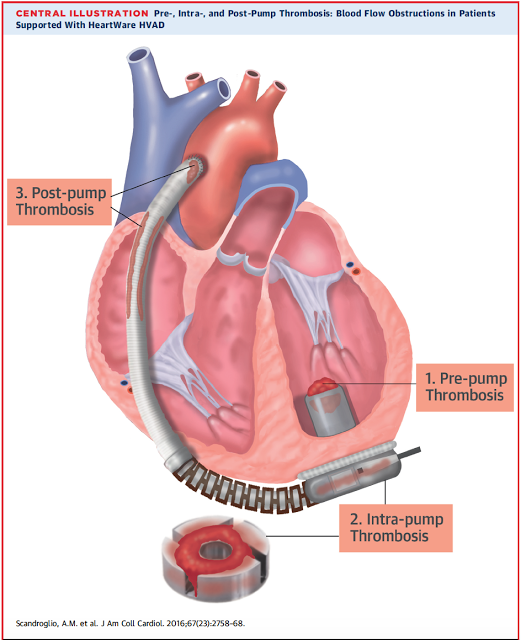
A) Por obstrução ao fluxo: o fluxo pelo dispositivo pode abruptamente se reduzir por alguma obstrução ao fluxo pelo dispositivo, neste contexto os parâmetros da bomba normalmente evidenciam diminuição do fluxo e queda do índice de pulsatilidade ( isto é: o VE diminui sua contratilidade e o dispositivo também não consegue aumentar seu fluxo). A obstrução ao fluxo pode ter diversas causas:
– Acotovelamento das cânulas entrada ou saída: em geral ocorre uma queda lenta e progressiva do fluxo, com marcadores de hemólise negativo e sem alteração da força do dispositivo. Extremamente raro na fase tardia do implante do dispositivo o diagnóstico é confirmado por Tomografia de tórax com contraste
– Trombose de Bomba: a trombose da bomba pode ser tanto na cânula de entrada (influxo), na bomba em si ou na cânula de saída (efluxo. De acordo com o sítio de trombose a manifestação clínica e o tipo de alarme do dispositivo são variáveis. Para Trombose na cânula de entrada em geral a queda de fluxo é abrupta e os marcadores de hemólise estão próximos aos valores basais ou discretamente elevados. Trombose da BOMBA em si cursa com marcadores de hemólise extremamente elevados associados com elevação do valor de força do dispositivo. Trombose da cânula de saída cursa com queda lenta e progressivo do fluxo e com achados característicos no ECO ( gradiente na cânula de saída) ou na AngioTC ( visualização do trombo).
O Manejo da trombose depende do sítio em que ocorre, a trombólise em geral é so indicada para trombose da bomba em si e se diagnosticada de forma precoce. Para casos com hemólise importante e urina escura a troca da bomba é quase que mandatória.
B) Por Disfunção de Ventrículo Direito
A disfunção tardia do VD pode eventualmente levar a uma falência de bomba pelo baixo fluxo pela cânula de entrada do dispositivo. A disfunção do VD deve ser tratada de maneira habitual, em geral com diurético e inotrópicos. O tamponamento cardíaco também pode levar a insuficiência de bomba e deve ser tratada urgentemente. Ocasionalmente a embolia pulmonar mesmo que de pequena magnitude pode levar a disfunção de um VD que já estava trabalhando no seu ‘limite’ e se apresentar clinicamente como uma disfunção primária de bomba, a avaliação clínica, hemodinâmica e com exames de imagem pode fornecer o diagnóstico de TEP como causa da disfunção de bomba.
C) Por Hipovolemia
Sangramento ou desidratação podem levar a disfunção da bomba, nestas situações clínicas o fluxo não consegue ser mantido pelo bomba, deve ser tratado inicialmente com reposição de volume
D) Insuficiência Aórtica
O fato da valva aórtica não abrir de maneira intermitente predispõe o indivíduo a desenvolver insuficiência aórtica anos após o implante do dispositivo, essa complicação que em geral é diagnosticada pelo Ecocardiograma ( pois o murmúrio típico de Insuficiência Aórtica é extremamente difícil de se auscultar com o dispositivo funcionante). O Problema da Insuficiência Aórtica em indivíduos com LVAD é que se forma um circuito fechado ( Sangue Ejetado pelo dispositivo na Aorta –> Retorna ao VE pela IAo –> Sangue ejetado novamente pelo dispositivo) diminuindo de forma acentuado o fluxo anterógrado para Aorta Ascendente e ramos. Em geral opta-se pelo fechamento percutâneo da valva aórtica ou TAVI.
Leitura Recomendada:
1) Hannan MM, et al. Working formulation for the standardization of definitions of infections in patients using ventricular assist devices. J Heart Lung Transplant. 2011
2) Wilson et al. Ventricular Assist Devices: Outpatient Management. JACC 2009
3) S.E.A. Felix et al. Continuous-flow left ventricular assist device support in patients with advanced heart failure. EJHF 2012
4) De Vore et al. Medical Management of Patients With Continuous-Flow Left Ventricular Assist Devices. Curr Treat Options Cardiovasc Med. 2014
4) Estep et al. Continuous flow left ventricular assist devices: shared care goals of monitoring and treating patients. Methodist Debakey Cardiovasc Journal 2015
5) Smith and Franzwa. Outpatient LVAD management. J Thorac Disease 2015
6) Slaughter et al. Clinical management of continuous-flow left ventricular assist devices in advanced heart failure. JHLT 2010
http://www.ncbi.nlm.nih.gov/pubmed/201814997) Suarez J, et al. Mechanisms of bleeding and approach to patients with axial-flow left ventricular
assist devices. Circ Heart Fail. 2011
8) Scandaglio et al. Diagnosis and Treatment Algorithm for Blood Flow Obstructions in Patients With Left Ventricular Assist Device. JACC 2016
9) International Society for Heart and Lung Transplantation Guidelines for mechanical circulatory support. JHLT 2013