-
ECMO (Oxigenação por membrana extra-corpórea) trata-se de um dispositivo para assistência artificial pulmonar (ECMO-VV) ou cardiopulmonar (ECMO-VA).
-
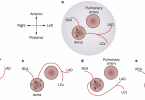
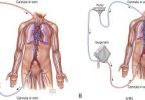
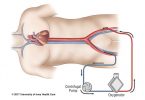
Basicamente é composta por um conjuntos de cânulas, uma bomba propulsora, um console de controle e uma membrana de oxigenação. A cânula de drenagem tem a missão levar o sangue no sentido corpo-> ECMO , onde o mesmo será oxigenado através de uma membrana e, posteriormente, devolvido no sentido máquina -> corpo (cânula de retorno). A cânula de drenagem sempre está em um sítio venoso e a cânula de retorno poderá estar posicionada no sistema venoso ou no arterial. É esse posicionamento que irá ditar o sito de assistência fornecida. Se a cânula de drenagem e a cânula de retorno estão vinculadas ao sistema venoso (por exemplo, drenagem em veia femoral e retorno em veia jugular) a assistência fornecida será apenas o de suporte ‘pulmonar’, uma vez que o sangue ainda terá que passar pelo sistema cardiopulmonar para chegar no sistema arterial do paciente. Se a cânula de drenagem está no sistema venoso e a de retorno na sistema arterial, observamos que o sangue – já oxigenado – irá realizar um ‘bypass’ no sistema cardio-pulmonar e, portanto, esse tipo de assistência irá auxiliar as funções tanto pulmonares, quanto cardíacas. O fluxo básico é: paciente -> cânula de drenagem -> bomba propulsora -> membrana de oxigenação -> cânula de retorno -> paciente.
- A ECMO veno-venosa possui uma cânula de drenagem – posicionada, via de regra, na veia cava inferior próximo a junção com o átrio direito – e uma cânula de retorno, na qual sua extremidade desemboca na veia cava superior (em geral, através da punção da veia jugular direita, quando possível). A ECMO veno-arterial pode ser feita por instalação central (cardiotomia – no centrocirúrgico) ou periférica (podendo ser realizada a beira leito). Nesse último cenário, em geral, a abordagem preferencial é a canulação bifemoral: cânula de drenagem na veia femoral e cânula de retorno na artéria femoral. Obviamente, existem várias possibilidades para esse tipo de assistência.
-
O sangue é direcionado através da cânula de drenagem para uma membrana, que realizará a oxigenação desse sangue para, posteriormente, devolvê-lo para o corpo do paciente. Essa oxigenação ocorre através de uma membrana própria e para que o fluxo sanguíneo ocorra deve-se ter um gradiente de pressão pré e pós-membrana. Isso gradiente – transmembrana – deve ser monitorizado e, em geral, deve ser menor que 20-30 mmHg. Esse gradiente é visualizado em um monitor acoplado ao console da ECMO. Caso exista um aumento desse gradiente deve-se questionar a qualidade da membrana, dado que um aumento das pressões pode estar associado ao mal funcionamento da mesma, como em casos de “trombose” do seus poros.
-
A movimentação do sangue é proporcionada através de uma ‘bomba’ que é a responsável por ‘sugar’ o sangue do paciente e direcioná-lo à membrana de oxigenação. Essa bomba funciona conectada na rede de energia e também tem uma bateria que fornece um autonomia de acordo com o fabricante mas, em geral, de pelo menos 2 horas. No console da ECMO você controla as rotações por minuto (RPM) e, indiretamente, o débito que será gerado (em Litros/min). Em caso de falha de energia elétrica/bateria, existe uma manivela que deve ser acionada para o funcionamento manual da ECMO. Nesse caso, deve-se tirar a parte ‘redonda’ da centrífuga e colocar na manivela de maneira que as RPMs sejam comandadas através de rotação manual.
-
Deve-se também ficar atento ao leitor que mede o débito cardíaco (posicionado junto a bomba propulsora). Nesse caso, sempre deixar lubrificada sua porção lateral com creme nívea ou com gel de transdutor de ultrassonografia (se não houver a correta lubrificação, pode haver falha no cálculo estimado do débito cardíaco e soar alarmes do console).
-
O controle de oxigenação/metabólico é feito através de coletas de gasometria em 3 pontos: 1 via do paciente, outra via de um ponto ‘pré-membrana’ e outra via de um ponto ‘pós-membrana’. No paciente, você almeja valores normais de BIC, pH, PCO2 e PO2. Em relação a membrana, o que você espera é que haja um aumento dos valores de PO2 e queda de PCO2 quando comparadas o pré em relação ao pós-membrana, uma vez que é justamente isso que você espera que aconteça. O valor da PO2 pós-membrana deve ser de, pelo menos, 200 mmHg.
-
Via de regra o paciente fica submetido a algum grau de anticoagulação. Em geral, com bomba de heparina não-fracionada. Se não houver uma indicação formal de anticoagulação (por exemplo, na vigência de tromboembolismo pulmonar), pode-se ajustar a infusão para TCA entre 160-200 ou guiar por TTPa seria uma opção (em torno de 1,5-1,8). Ressalto que esse ajuste deve ser individualizado de acordo com seu protocolo institucional, junto aos especialistas em ECMO.
-
O funcionamento da membrana é análago ao que ocorre na ‘hemodiálise’. O fluxo de gás rico em O2 e sem CO2 deve chegar com 100% e vai em ‘contra-corrente’ em relação ao fluxo sanguíneo. A remoção do CO2 depende do fluxo que esta passando na máquina (RPM) e também de um fluxo do oxigenador que fica próximo ao console (é um dispositivo em que você controla a FiO2 e o fluxo). Na prática o fluxo do Blender / SWEEP serve para determinar a lavagem de CO2. A oxigenação depende pouco desse fluxo ( a não ser se ele estiver muito baixo), ou seja, se o PCO2 do paciente (coletado na PAi) estiver ‘alto’, deve-se aumentar o fluxo pelo SWEEP e, se estiver baixo, pode-se diminuir o fluxo pelo SWEEP ( essa variação do fluxo do SWEEP que gerou o termo “em português” do “verbo” SWEEPAR).
-
Uma complicação comum é o ‘chicoteamento’ do sistema. Isso ocorre, via de regra, por fricção das cânulas junto as estruturas intra-vasculares a qual estão diretamente relacionadas. Frente a ocorrência disso as seguintes medidas podem auxilar : – elevar a cabeceira do leito, – colocar paciente em decúbito lateral, – diminuir o fluxo sanguíneo da ECMO e, após, aumentá-lo lentamente, – aumentar a PEEP, – transfundir CH, – expansão volêmica e/ou iniciar drogas vasoativas. Cabe ao médico na beira-leito definir quais dessas medidas seriam as mais adequadas de acordo com o estado do paciente.
-
ECMO – VV: nesse cenário sempre ficar atento a re-circulação. O que ocorre é que as extremidades das cânulas de drenagem e de retorno são relativamente próximas. Sendo assim, um sangue já oxigenado por ser novamente “aspirado” para ir pra ser novamente oxigenado. Sendo assim, deve-se evitar que as cânulas fiquem muito próximas umas das outras (o uso da ecografia esofágica durante a instalação do dispositivo auxilia no correto posicionamento e ajuda a mitigar a ocorrência desse problema). Via de regra, deve-se ter um distanciamento entre as extremidades das cânulas em 8 cm (isso pode ser visualizado pelo RX de Tórax de controle ou com o auxílio do ecocardiograma durante o procedimento). Lembrar que, nesse caso, a gasometria pré-membrana, via de regra, tem valor de pAO2 mais alto que o pAO2 real do doente, uma vez que ele conta, também , com sangue re-circulado e, portanto, já oxigenado. Se a saturação arterial de O2 está alta e o O2 pré membrana também, deve estar havendo re-circulação. A importância em se diagnosticar o fenômeno da recirculação é devido ao fato de que nessa situação o aumento do ‘débito da ECMO’ não resultará em melhora da oxigenação do doente. Já se O2 pré membrana estiver baixo e o arterial também estiver baixo deve estar havendo: shunt (débito cardíaco muito alto ou fluxo da ECMO baixo. Nessa situação, se o DC estivar alto: pensar em reduzir com esmolol, por exemplo).
-
ECMO-VA periférica pode estar associada a Síndrome de Arlequim e a sobrecarga importante do ventrículo esquerdo. Na síndrome de Arlequim ocorre uma diferente distribuição do sangue oxigenado. A parte superior do tronco do paciente fica mal perfundida dado que o sangue dai é predominantemente proveniente do coração do doente e não da ECMO. Sendo assim, deve-se manter a monitorização oximétrica de ambas mãos, dado que há grande chance de haver problema com relação a perfusão dos membros (esquerdo pode ser melhor perfundido que o direito. Uma sugestão é monitorizar a oximetria em MSE e coletar gasometrias do MSD a procura de discrepância de valores). Deve-se, também, ficar atento a isquemia distal ao sítio de canulação arterial! A isquemia do membro inferior pode ser minimizada através da colocação de um cateter para perfusão distal do membro inferior.
-
Ponderar inotrópico para o ventrículo esquerdo caso edema pulmonar ou mesmo importante dilatação. Ponderar, também, balão-intra aórtico numa tentativa de diminuir a pós-carga do ventrículo esquerdo.
-
O fluxo mínimo da ECMO-VA deve ser algo em torno de 1500 rpm e, provavelmente, algo em torno de 1.5 L/min de débito auxiliar. Valores menores que esse estão associados a risco de trombose do sistema.
- A ECMO-VA cria um shunt no coração de maneira que temos uma um débito cardíaco total que a soma do DC residual do paciente + DC da máquina. Sendo assim, para um determinado aumento do DC do doente – considerando o débito da ECMO fixo – teremos um potencial piora da oxigenação. Existe uma relação entre DC total e DC do ECMO da seguinte forma -> DC ECMO / DC Total. Se for de 1, significa que todo fluxo está na ECMO. Lembrar que um fluxo muito alto pode gerar deterioração da membrana.
-
Manejo da ventilação, em geral, adotam-se parâmetros protetores, tais como: PEEP até 10 mmHg, VC 6-8 ml/kg, pressão de platô 20-25 cmH20, FR mais baixa em 10-15 irpm. Mais uma vez ressalto que a estratégia ventilatória deve ser individualizada.
- Uma vez instalada a ECMO para suporte VA, em geral, não se realizam tentativas de desmame nas primeiras 48-72h. Uma vez decidido por tentativa de desmame devem-se observar alguns parâmetros clínicos e ecocardiográficos expostos abaixo:
-
Parâmetros para se aventar o desmame da ECMO-VA:– Ao ecocardiograma: FE > 20-25 %, VTI > 12 cm e anulo mitral lateral com S’ > 6 cm/s.-Clínicos: clínicos para desmame: FiO2 do circuito 21-30 %, FiO2 do paciente < 60 %, relação PAO2/FiO2 > 200, função hepática normalizada, ECMO com volume 1 L/min tolerado e o Fluxo do SWEEP em 1 L / min, onda pulsátil mantida, baixa dose de drogas, PAM > 60 mmHg
-
Teste do desmame da ECMO-VA: Baixar o fluxo da ECMO para 1 -1.5 L/min e o SWEEP gás para 1L/min com Fi02 em 21% por 15 minuto. Se a PAM cai significativa para PAM < 60 mmHg o teste deve ser interrompido. Avaliar, concomitantemente, o ecocardiograma e buscar variáveis da função biventricular: S´lateral, TAPSE, tamanho do VD, VTI, tamanho do VE, diâmetros.
-
Outros autores propõem uma diminuição progressiva do suporte, em geral entre 0.5 – 1 L/min por fase, e observam-se seguintes parâmetros: hemodinâmico: PVC < 15, PAM/PVC >= 1.5, PAM > 65, PP > 30 mmHg, FEVE > 25 %, sem distensão do VD / VE, sem estase. Caso o paciente vá tendo sucesso nessas variáveis o protocolo segue. Uma vez o paciente tendo sucesso, deve-se providenciar a decanulação o mais célere possível.
Leitura recomendada:
- Venoarterial Extracorporeal Membrane Oxygenation for Cardiogenic Shock and Cardiac Arrest. Cardinal Considerations for Initiation and Management. Circ Heart Failure. Volume 11, Issue 9, September 2018. Disponível aqui.
- Veno-Arterial Extracorporeal Membrane Oxygenation for Cardiogenic Shock An Introduction for the Busy Clinician. Circulation. 2019;140:2019–2037



[…] extremidades a fim de evitar o fenômeno de recirculação do sangue (leia sobre a recirculação nesse post). Além disso, deve-se monitorizar a ocorrência de derrame pericárdio por trauma/perfuração de […]